2023. 11. 15. 15:14ㆍ배터리/전고체 배터리 (All Solid State Battery)
황화물 고체 전해질(Sulfide Solid Electrolytes)
황화물 고체 전해질은 리튬과 황을 주성분으로 함유하고 인, 규소, 게르마늄 또는 할로겐화물 등 다양한 화합물과 결합합니다. 황화물은 유리 (Glass), 결정질 (Crystalline) 또는 유리-세라믹 (Glass-Ceramic) 상태로 가공되어 다양한 특성을 나타냅니다.

장점
1) 높은 이온전도도
지난 1010년 동안 황화물 전해질에 대한 과학계와 산업계의 관심이 증가해 왔는데 그 이유는 황화물 고체 전해질이 최신 LIB기술에서 사용되는 액체 전해질과 유사하거나 그보다 더 높은 이온 전도도를 가지기 때문입니다.
이는 액체 전해질의 이온전도도의 대부분이 전해질 내의 음이온에 기반하기 때문에 리튬이온 전달률(Li-ion transference number)이 0.5보다 낮은데 비해 황화물 고체 전해질은 이온전도도의 100%가 리튬이온의 이동을 기반으로 하기 때문에 리튬 이온 전달률(Li-ion transference number)이 거의 1이기 때문입니다.
산화물 고체 전해질에 비해 황화물의 전도성이 우수한 것은 황원자가 산소 원자에 비해 훨씬 소프트하고 분극성 (Polarity)이 크기 때문입니다. 리튬 이온은 황 원자와의 상호작용이 약하기 때문에 황화물 고체 전해질에서 이동도가 더 높습니다.
2) 가공이 용이
더욱이, 황화물계 전해질 재료는 가소성과 부드러운 특성을 가지고 있어 가공이 용이하므로 양극/음극 활물질과의 계면에서 우수한 계면특성을 만들어낼 수 있습니다.
3) 우수한 계면 특성
산화물 고체 전해질은 값비싼 고온 소결 공정이 필요하지만 대부분의 황화물 고체 전해질은 냉간 압착이나 고압 캘린더링을 통해 제조할 수 있습니다.
황화물 고체 전해질은 고압을 통해서 양호한 접촉(낮은 결정 경계 저항)을 갖도록 할수 있으며 양호한 전극-전해질 접촉을 갖는 매우 조밀한 층을 만들 수 있습니다.
4) 리튬 덴드라이트 형성 방지
산화물 고체 전해질의 경우 리튬 덴드라이트는 대부분 결정립 경계, 공극 또는 기타 결함에서 핵을 형성하고 이를 따라 전파되는데 고압을 통해 형성된 황화물 고체 전해질과 전극의 조밀한 층은 리튬 덴드라이트 형성을 방지하는 데 도움이 됩니다.
5) 수명 향상
황화물 고체 전해질의 가소성은 부서지기 쉬운 산화물 재료에 비해 사이클링 동안 부피변화로 인한 기계적인 열화를 막아주어 더 나은 수명을 가능하게 합니다.
개선 과제와 해결책
1) 불안정성: H2S생성
자주 언급되는 황화물 전해질의 단점은 공기 중 불안정성입니다. 황화물은 흡습성이 있으며 산소와 접촉하면 SO2를, 수분과 접촉하면 독성 가스인 H2S를 형성합니다. 따라서 황화물은 제조 과정에서 건조한 분위기에서 제조되어야 합니다. 전해질이 미세한 분말 형태로 취급되는 초기 생산 단계에서는 아르곤 같은 불활성 기체로 채워진 불활성 분위기에서 취급이 돼야 하지만 전해질이 조밀한 층을 형성하고 나면 건조한 공간에서 작업할 수 있습니다. 일반적으로 배터리 셀은 밀폐되어 있기 때문에 가스가 발생하지 않으므로 배터리 작동에는 문제가 없지만 배터리가 손상되게 되면 H2S, SO2가 형성될 수 있어 잠재적으로 안전에 위협이 되는 요소를 가지고 있습니다. 한 가지 가능한 해결책은 제올라이트 (zeolite)와 같이 H2S 및 H2O를 흡수할 수 있는 물질을 고체 전해질에 추가하는 것입니다. 일반적으로 전문가들은 황화물의 수분 불안정성이 곧 해결될 것이라고 믿으며 비관적으로 평가하지는 않습니다.
2) 고체 전해질과 양, 음극 계면의 불안전성
황화물은 약 1.7V 대 Li/Li+ ~ 2.1–2.3V 대 Li/Li+의 작은 전기화학적 안정성 창만 나타냅니다. 운동 장벽으로 인해 실제 제품에 적용했을 때는 Kinetic Barrier로 인해 더 높은 안정성을 나타냅니다. 더욱이, 다양한 황화물간에는 상당한 차이가 있습니다. 그럼에도 불구하고 황화물은 낮은 전위에서 리튬 금속과 반응하고 더 높은 전위에서 양극 활물질과 반응합니다. 고체 전해질과 CAM의 반응에 의해 형성된 CEI (Cathode Electrolyte Interface)는 주로 황산염(sulfates)과 인산염(phosphates)으로 구성되며 둘 다 리튬 이온과 전자적으로 절연되어 있어 인터페이스 저항이 높습니다. 음극에서 고체 전해질과 반응하여 생성되는 SEI (Solid Electrolyte Interface)는 Li2S, Li3P 또는 LiCl과 같은 분해 생성물로 형성됩니다. 이들은 모두 고체 전해질보다 이온 전도도가 상당히 낮기 때문에 인터페이스 저항이 발생하고 배터리 성능이 저하됩니다. 더욱이, 리튬 덴드라이트의 형성은 리튬 금속과 황화물 고체 전해질의 계면에서 또 다른 주요한 문제입니다. 여러 요인이 덴드라이트 형성에 영향을 미치므로 리튬 금속을 음극으로 사용하는 전고체 전지를 개발할 때 고려해야 합니다.
양극과 음극의 제한된 인터페이스 안정성은 SSB에 황화물 고체 전해질을 SSB애 적용하는 데 가장 큰 장애물입니다. 일반적으로 고체전해질과 활물질 사이의 직접적인 접촉을 피하기 위해 인공 SEI/CEI 역할을 하는 전극 코팅(예: 양극의 Li7La3Zr2O12 또는 음극의 LiNbO3)을 하는 것이 일반적인 해결 방법입니다.
다른 해결책으로는 고체 전해질 표면을 산소(S와 O 원자의 교환)로 도핑하여 표면 안정성을 향상시키고 양, 음극 활물질과 고체 전해질 입자의 크기를 조정하여 계면 저항을 최소화하는 것입니다.
음극의 경우 최근 3D 복합 리튬 금속 전극 (3D Li metal composite)을 만드는 방식이 주목을 받고 있습니다. 리튬 금속을 메쉬형태의 구리 집전체나 니켈 폼과 같은 3D 호스트 구조에 결합시켜 부피 팽창을 제한하고 dentrite 형성을 억제합니다


또한 최소한의 전자전도성을 가진 결함 없는 고체 전해질을 제조하여 안정적인 인터페이스와 강력한 dendrite 생성을 억제하는 방법도 있습니다.
양극의 경우 최소한의 변형을 갖는 양극 활물질을 사용하면 사이클링 동안 부피 변화가 매우 낮아 양극과 고체 전해질사이의 인터페이스에서의 반응을 최소화할 수 있습니다.
전문가들은 황화물 전해질의 상용화를 위해서는 양극과 고체전해질과의 호환성도 매우 중요하지만 리튬 금속과의 기능적인 인터페이스가 더 중요하다고 생각합니다. 그러나 아직 사이클링 중에 발생하는 특정 메커니즘에 대한 지식이 충분하지 않으며 Li 금속 자체가 덴드라이트 형성과 같이 여전히 해결해야 될 많은 과제가 남아 있습니다.
3) 가격
황화물 SSB가 널리 채택되기 위해서는 고체전해질 소재의 가격이 저렴해지고 대량생산을 할 수 있어야 합니다. Li10GeP2S12와 같이 게르마늄을 함유한 고가의 황화물은 어렵겠지만 지구상에 많이 분포하는 원소들을 포함하는 LPS 계열이나 argyrodite 계열 황화물은 가격을 낮출 수 있습니다. 그럼에도 불구하고 아직 전구체 공급망 (특히 Li2S의 경우)이 개발되지 않았고 제조 공정에 대해서도 여전히 많은 불확실성이 존재합니다. 그러나 전문가들은 장기적으로 제조 및 공급망 확장에 따른 이러한 과제들은 해결될 것이므로 황화물 고체전해질 상용화의 주요 걸림돌로 보고 있지는 않습니다.

황화물 재료
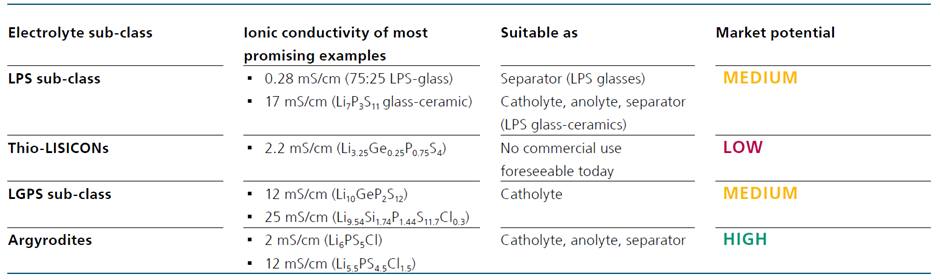
황화물은 Glass, Glass-Ceramic, Crystalline 재료로 나눌 수 있습니다. 가장 눈에 띄는 glass와glass와 Glass-Ceramic은 LPS 계열의 일부입니다. Crystalline재료로 유망한 것은 LGPS 계열과, argyrodites 및 Thio-LISCON입니다.
1) LPS 계열
LPS 계열 재료들은 수년 동안 조사되었으며 바이너리 xLi2S(100–x)P2S5 시스템(x = mole 백분율)에서 파생된 Glass 및 Glass-Ceramic들이 있습니다.
가장 많이 연구된 LPS 계열 Glass재료는 75Li2S·25P2S5(75:25 LPS)입니다. 이 재료는 이온전도도가 0.28mS/cm로 Glass계열 중 실온에서 가장 높은 이온 전도도를 가지며 다른 Glass계열 황화물보다 높은 온도에서 더 높은 안정성을 보여줍니다
LPS Glass-Ceramic은 유리가 부분적으로 결정화되는 특정 온도에서 LPS Glass를 어닐링 하여 형성됩니다. 일반적으로 유리가 결정화되면 이온전도도가 낮아지기 때문에 리튬 이온 전도도를 감소시킵니다. 그러나 바이너리 LPS 시스템의 경우 어닐링 중에 초이온성 준안정 결정상(superionic metastable crystalline phases)이 형성됩니다(x ≥ 70의 경우). 가장 유망한 Glass-Ceramic은 70:30 LPS Glass를 결정화시켜 만들어집니다. 침전된 Li7P3S11 초이온 결정상(superionic crystalline phases)은 최대 17mS/cm의 매우 높은 이온 전도도를 나타냅니다.
Glass-Ceramic과 특히 Glass계열의 황화물은 Crystalline 황화물보다 전극 활성 물질에 대해 더 높은 안정성을 나타냅니다. Glass에는 결정립 경계가 없어 리튬덴드라이트 형성을 방지하는 데 도움이 되며 Glass의 가소성은 부피 변화를 보상할 수 있습니다. 리튬 금속을 음극으로 사용하는 경우 완전히 안정적이지는 않지만 리튬이온 배터리처럼 전자적으로 격리된 SEI를 형성하여 추가 분해를 방지하고 안정된 수명특성을 가질 수 있습니다. 그럼에도 불구하고, 계면저항이 존재하므로 양극판은 반드시 코팅이 필요하며 음극도 코팅을 할 필요가 있습니다.
LPS 계열 재료들은 상업용 응용 분야에 적용하기에 좋은 특성을 가지고 있지만 Glass계열의 경우 다른 황화물 재료들에 비해 이온 전도도가 너무 낮아 Catholyte나 Anolyte재료로 사용하기에는 경쟁력이 없습니다. 그러나 우수한 안정성, 경량 및 잠재적인 저비용으로 인해 고체전해질 분리막 재료로는 유망합니다.
Glass-Ceramic, 특히 전도성이 높은 Glass-Ceramic인 Li7P3S11은 미래 SSB에 적용할 수 있는 매우 유망한 특성을 나타내지만 저저항 전극을 개발해야 하며 고체전해질 계면저항의 문제를 해결해야 합니다..
2) Thio-LISICON
β-Li3PS4와 같은 Thio-LISICON은 2000년에 소개되었으며 LISICON의 산소를 황으로 대체시켜 만들어진 유사체입니다. LISICON의 γ-Li3PO4 구조로 결정화되어 있으며 산소와 치환된 더 부드러운 물성의 황은 산화물에 비해 더 높은 전도성을 가능하게 합니다.
Thio-LISICON 계열에는 LixM1-yM'yS4(M = Si 또는 Ge, M'= P, Al, Zn, Ga 또는 Sb)의 화학식을 가지는 다양한 재료가 있으며 이온 전도도는 0.0001mS/cm~1mS/cm입니다. 다른 원소들로 대체하면 다양한 특성을 지닌 더 많은 유사체를 만들어 낼 수 있습니다.
가장 높은 전도성을 나타내는 재료는 Li4-xGe1-xPxS4(0<x<1)과 같은 화학식을 갖는 그룹이며 이는 LGPS의 발견으로 이어졌습니다. (LGPS는 다른 Thio-LISICON과 구조가 다르기 때문에 별도로 그룹화합니다.) Li3.25Ge0.25P0.75S4는 Thio-LISICON 그룹 중에서 2.2mS/cm로 가장 높은 전도성을 나타냅니다.
Thio-LISICON은 SSB와 관련하여 조사된 최초의 결정질 황화물 전해질이지만 다른 결정질 황화물에 비해 낮은 Li 이온 전도도를 나타내며 Glass계열의 LPS보다 안정성이 낮습니다. 상업용 배터리에 Thio-LISICON을 사용하는 것은 거의 불가능해 보입니다. Thio-LISICON은 매우 다양하므로 추가적인 R&D 노력을 통해 이온 전도도와 안정성이 향상되면 응용이 가능할 수 있습니다.
3) LGPS 계열
2011년 리튬 초이온 전도체 (Superionic conductor)로 불리는 LGPS (Li10GeP2S12)의 발견은 황화물 고체전해질에 대한 관심을 촉발하고 연구를 가속화하는 계기가 됐습니다.
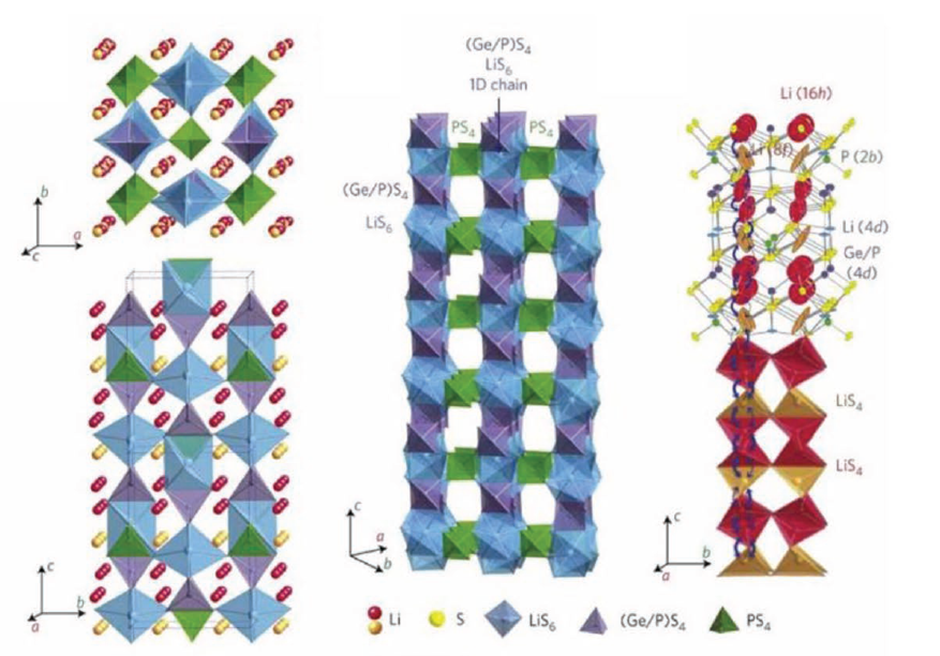
LGPS는 12mS/cm의 이온 전도도를 나타내며 이는 액체 전해질의 이온 전도도(약 20mS/cm)와 비슷합니다. 높은 전도성은 가장자리에 연결된 LiS6 팔면체와 (Ge0.5P0.5)S4 사면체 체인이 cc 축을 따라 신속한 1D Li 이온 확산을 가능하게 하는 LGPS의 결정 구조에 기인합니다. 1D 확산은 ab 평면에서 느린 2D 확산으로 보완되어 LGPS를 3D 도체로 만듭니다. 1D 전도 경로는 LGPS 계열의 특징입니다.
LGPS의 큰 단점은 고가의 게르마늄을 함유하고 있어 대량생산이 불가능하다는 점입니다. 따라서 게르마늄을 실리콘과 주석으로 대체하는 등가 치환에 대한 집중적인 연구가 진행되고 있습니다.
가장 눈에 띄는 예는 리튬 이온 전도도가 25mS/cm인 Li9.54Si1.74P1.44S11.7Cl0.3입니다. 이는 보고된 모든 고체 전해질 중 가장 높은 이온전도도이며 액체 전해질을 능가하는 값입니다. 그러나 이 구조는 LGPS에 비해 훨씬 낮은 전기화학적 안정성을 보입니다.
높은 비용 외에도 LGPS 계열의 전기화학적 안정성도 문제가 됩니다. LPS 계열과 달리 LGPS계열 황화물은 전기 전도성 분해 생성물을 형성하여 불안정하고 지속적으로 성장하는 SEI를 생성하여 높은 인터페이스 저항을 만들어내며 궁극적으로 전해질이 완전히 분해됩니다. 결과적으로 LGPS 고체 전해질과 리튬 금속 음극 사이의 직접적인 접촉은 상업적 용도로 불가능하므로 고체 전해질 분리막 재료로 사용 가능성은 낮아 보입니다. 대조적으로, 높은 전도성은 충분한 전기화학적 안정성을 갖는 저비용, 게르마늄 프리 재료가 개발될 수 있다면 LGPS 계열의 구성원을 유망한 Catholyte로 만들 수 있습니다.
4) Argyrodites
Argyrodites의 이름은 처음 발견된 Silver (argentum) argyrodite Ag8GeS6에서 유래되었습니다. 리튬 유사체 Li6PS5X (X=Cl, Br, I)는 2008년에 발견되었으며 그 이후 집중적으로 연구되고 개선되었습니다. 특히 Chlorine argyrodite Li6PS5Cl 및 그 대체물은 상온에서 약 2mS/cm의 리튬 이온 전도도를 나타냅니다. 그러나 이 수치는 Li5.5PS4.5Cl1.5 (12mS/cm)와 같이 원소를 변화시켜 증가시킬 수 있습니다.
Argyrodites는 Li 금속과 접촉하여 전기적으로 절연된 SEI를 형성하므로 LPS 하위 클래스와 유사하게 완전히 안정적이지는 않지만 Li 금속 음극과 호환됩니다. 그럼에도 불구하고 인터페이스 저항은 최소한으로 유지되어야 하므로 코팅 및 기타 가능한 인터페이스 솔루션을 양극과 음극에 적용해야 합니다. 그러나 LGPS 계열 황화물과 달리 Argyrodites는 게르마늄과 같은 고가의 금속을 포함하지 않으며 Li2S, P2S5, LiCl등의 전구체를 기반으로 제조되므로 잠재적으로 비용을 낮춰 효율적으로 생산할 수 있습니다.
Argyrodites는 현재 상업용 응용 분야에서 가장 유망한 고체 전해질 재료 중 하나로 간주되므로 다양한 SSB에서 테스트되고 있습니다. 가장 큰 과제는 고체전해질과 전극사이의 인터페이스 저항과 분해이지만 LGPS 계열보다는 더 낫습니다.
결론
황화물 고체 전해질은 고전력 배터리 셀을 가능하게 할 가능성이 있기 때문에 모든 SSB 중 자동차 응용 분야에 사용가능성이 가장 높은 재료로 여겨지고 있습니다.
액체 전해질에 필적하는 높은 리튬 이온 전도도를 나타내므로 산화물 고체전해질과 달리 Catholyte 재료로 유망합니다. 황화물의 가장 큰 단점은 전기화학적 안정성이 낮아 양극과 음극에서 계면 저항이 높다는 것입니다. 리튬 금속에 대한 안정성과 리튬 덴드라이트 발생의 문제는 여전히 주요 과제이며 이를 해결하는 것이 황화물 전고체 배터리를 상용화하는 방법과 시기를 결정하게 될 것입니다.
출처: Solid-State Battery Roadmap 2035+ (Fraunhofer ISI report)
'배터리 > 전고체 배터리 (All Solid State Battery)' 카테고리의 다른 글
| 전고체 배터리 전망_할로겐화물 및 붕산염 고체 전해질 (1) | 2023.12.07 |
|---|---|
| 전고체 배터리 전망_폴리머 고체 전해질 (1) | 2023.11.17 |
| 전고체 배터리 전망_산화물 고체 전해질 (0) | 2023.11.02 |
| 전고체 배터리 전망_양극활물질 (0) | 2023.11.02 |
| 전고체 배터리 전망_음극활물질 (2) | 2023.11.01 |
