2023. 11. 2. 17:38ㆍ배터리/전고체 배터리 (All Solid State Battery)
산화물 고체 전해질

산화물 고체 전해질은 명확하게 정의된 재료 종류가 아니라 리튬과 산소뿐만 아니라 인, 티타늄, 알루미늄, 란타늄, 게르마늄, 아연 또는 지르코늄과 같은 기타 구성 요소를 포함하는 화합물 그룹을 나타냅니다. 전고체 배터리의 처음 시작은 산화물을 분리막으로 사용하려는 시도로부터 시작되었습니다. 첫 번째 연구 프로젝트는 1970년대에 박막 배터리에 적용하는 것으로 시작이 되었고 1980년에 리튬이온전지(LIB)가 개발되면서 박막보다 두꺼운 Layer를 갖는 고체산화물전지에 대한 연구가 본격적으로 진행되었습니다.
장점: 기계적, 화학적 안정성, 넓은 전기화학창
산화물 고체전해질의 장점은 기계적 안전성이 크고, 전기화학적 창이 크며 화학적으로 안정하다는 것입니다.
특히 우수한 기계적 안정성은 다른 재료 시스템에 비해 가장 큰 장점입니다. 기계적 안정성 외에도 산화물 전해질은 일반적으로 화학적으로 안정적이며 큰 전기화학적 창을 제공하기 때문에 고전압 양극재료를 사용할 수 있습니다. (Perovskite 1.5~5.5V, Garnet 0~5.5V, Nasicon 2.5~5.5V). 화학적으로도 안정하므로 엄격한 건조실 조건이나 불활성 가스 분위기가 필요하지 않아 제조 시 환경요구 낮은 편입니다.
일부 산화물은 또한 리튬 금속과 화학적으로 안정하기 때문에 Li 금속 음극의 사용을 가능하게 합니다. 또한 다양한 치환체를 사용하여 다양한 화합물을 생성할 수 있기 때문에 높은 이온 전도도를 갖는 재료를 찾을 수 있습니다.
LLZO와 같은 산화물 고체 전해질은 열 폭주에도 안정적입니다 아래 그림과 같이 Nasicon (LATP, LAGP), Perovskite (LLTO), Garnet (LLZO) 4가지 산화물 고체전해질을 Li foil사이에 붙인 후 ARC테스트를 해보면 온도가 상승했을 때 산화물 고체전해질에서 산소가 발생하고 발생한 산소가 용융된 금속 Li과 발열 반응이 일으키며 열폭주가 발생하게 됩니다. 아래 그림에서처럼 Nasicon 계열의 LATP와 LAGP는 열폭주가 발생하고 Perovskite 계열의 LLTO는 약한 열폭주 반응이 일어납니다. 반면에 LLZO는 열폭주나 온도 상승이 없는 것을 알 수 있습니다.


개선해야 할 과제

1) 깨지기 쉬움: 롤투롤 공정 적용이 어려움.
산화물 전해질의 기계적 특성은 장점이지만 한편으로는 단단하고 부서지기 쉽습니다. 산화물 고체전해질을 대량으로 제조하기 위해서는 일반적인 LIB 공정에서처럼 포일 기반의 롤투롤(roll-to-roll) 공정으로 제조할 수 있어야 합니다. 그러기 위해서는 재료가 굽힘 및 롤링 공정을 거쳐야 하는데 재료가 뻣뻣하고 부서지기 쉬우면 롤투롤 공정에 적용하기가 어렵습니다. 이런 문제를 해결하기위해 산화물과 폴리머를 혼합하는 하이브리드 및 복합 고체 전해질 시스템을 만들어 취성과 강성을 줄여 롤투롤 공정에 적용할 수 있지만 이온전도도가 감소한다는 단점이 있습니다.
2) 계면저항 문제
산화물 고체전해질은 재료의 강성으로 인해 전극과 산화물 전해질 사이의 고체-고체 계면의 계면저항이 높아 이온전도도가 떨어집니다. 계면저항을 향상시켜 전체 성능을 높게 유지하려면 양호한 계면 접촉이 필요합니다. 또한 산화물 고체전해질은 유연성이 부족하여 충방전으로 인한 부피 변화를 견디기 쉽지 않습니다. 이러한 이유로 재료 화합물은 지속적으로 외부 압력에 노출되어야 합니다.
3) 리튬 금속과의 반응성
장점으로 위에서 언급한 Li 금속 양극과의 호환성은 모든 산화물 고체전해질에 적용되는 것은 아닙니다. 일부 산화물 전해질은 Li 금속과 화학적으로 반응합니다. 따라서 Li 금속 음극과 산화물 분리막 사이에 보호층이 필요합니다. 이러한 보호층은 리튬금속 음극과 고체전해질 분리막 위에 증착 방식으로 형성시킬 수 있습니다. 다른 방법은 전해질에 첨가제를 이용해 초기 충방전시 인공적인 SEI층을 형성하는 것입니다.
산화물 고체 전해질은 기계적인 안전성에도 불구하고 전류 밀도가 높아지면 리튬이 산화물고체 전해질의 결정입자의 경계를 따라 수지 형태로 성장할 수 있습니다. 리튬 금속을 사용할 때 발생하는 이러한 문제를 방지하기 위해서 실리콘과 같은 다른 음극 재료를 사용하는 방법이 있지만 이러한 방법은 리튬 금속에 비해 에너지밀도를 떨어뜨리게 됩니다.

4) 소결 온도 범위가 높음
산화물 재료는 결정 입자의 경계에서 경계면 저항이 존재하기 때문에 결정입자의 경계면을 치밀하게 만들어 이온전도도를 높여야 합니다. 입자 경계 저항이 낮은 치밀한 층을 얻기 위해서는 산화물 재료를 높은 온도에서 소결 (Sintering)하는 가공 단계가 필수적입니다. 소결 온도 범위는 산화물 종류에 따라 400~1300°C로 차이가 납니다.높은 소결 온도는 높은 에너지를 필요로 하고 그에 따라 비용이 증가하는 단점이 있습니다. Garnet형 산화물은 소결 온도를 기존 1000°C 이상에서 800°C 미만으로 낮추는 것이 가능하다고 알려져 있습니다. 그러나 낮은 소결 온도는 이온 전도성에 부정적인 영향을 미칠 수 있습니다. 양극판을 제조하기 위해 산화물 재료를 양극 활물질(CAM)과 어닐링해야 한다면 더욱 문제가 됩니다. 양극 활물질은 고온에서는 안정적이지 않으며 분해 반응이 발생하기 때문입니다. 이를 해결하는 방식 중의 하나는 첨가제를 사용하여 어닐링 온도를 낮추는 것입니다. 이 방법은 이미 산화물 고체전해질재료와 함께 LCO의 어닐링 온도를 700°C까지 성공적으로 낮추는 사례가 보고되었습니다. 또 다른 대체 공정은 불활성 분위기에서 빠른 속도로 높은 온도에서 소결 (UHS : Ultrafast High-temperature Sintering) 하는 것입니다.
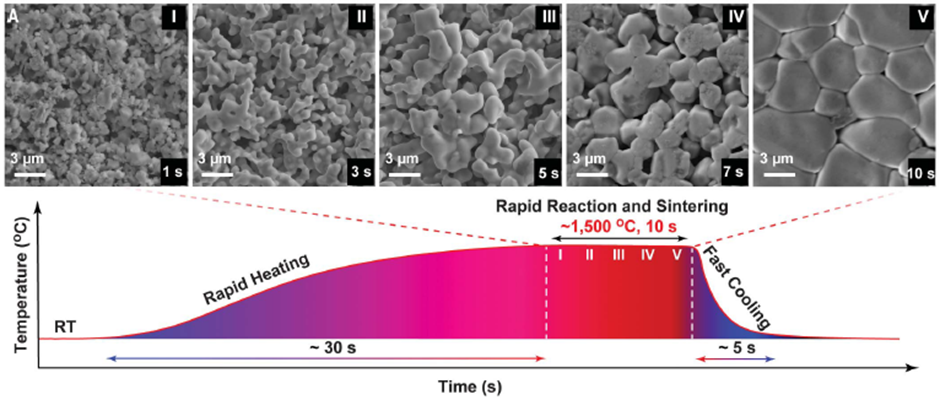
또 다른 방법은 아래 그림과 같이 다공성 산화물 전해질을 제조한 후 산화물 전해질 Pore안에 양극 활물질 원재료를 용액상태로 채워놓은 후 고온에서 소성하는 방법입니다
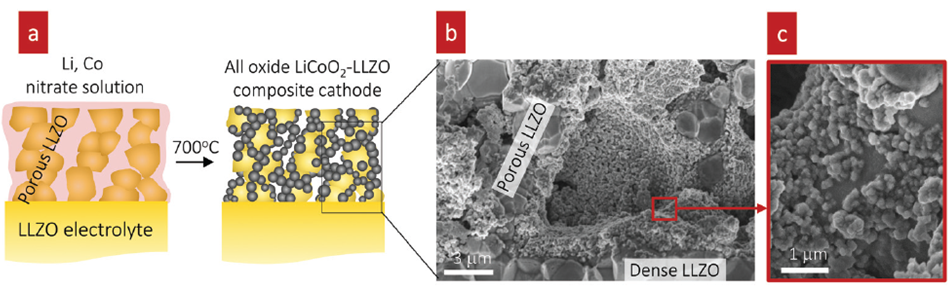
양극 활물질을 보호층으로 코팅하여 고온 소결시 열 효과에 대한 저항력을 높이는 방법도 있습니다.
아직 성숙한 기술은 아니지만 에어로졸 증착과 같은 건식 처리 경로를 사용하면 더 낮은 온도에서 어닐링이 가능하므로 고온 소결할 필요가 없습니다. 이 필요하지 않은
5) 낮은 이온전도도
산화물의 이온 전도도는 고체전해질로 사용할 수 있는 수준입니다. 그러나 양극판의 두께가 두꺼워야 하는 고에너지 전지의 경우 Catholyte로 사용하기에는 이온전도도가 너무 낮습니다. 이온 전도도를 높이기 위해 치환기를 사용할 수 있지만 실온에서 1mS/cm를 훨씬 넘는 전도도에는 아직 도달하지 못했습니다.
이러한 문제를 해결하기위해 Catholyte으로 겔과 고체 전해질의 혼합물을 사용하는 하이브리드 방식을 적용할 수 있습니다. 이 방법은 고체전해질과 함께 양극활물질을 어닐링 하지 않아도 되므로 양극의 제조 방식을 단순화할 수 있습니다.
또 다른 방법으로 분리막으로는 산화물 재료를 사용하고 Catholyte으로는 산화물보다 더 높은 이온 전도도를 갖는 황화물을 사용하는 방법도 있습니다.
또한, Catholyte의 성능을 높이기 위해 폴리머 성분을 산화물에 첨가할 수도 있습니다. 이방법은 이온전도도는 낮아지지만 Catholyte의 습윤 특성을 향상시킬수 있습니다.
6) 박막 가공
배터리에서 더 높은 에너지 밀도를 달성하려면 고체 전해질이나 고체 전해질 분리막과 같은 비활성 물질의 질량은 낮게 유지해야 합니다. 일반적으로 산화물은 황화물이나 고분자에 비해 비중이 높기 때문에 산화물 분리막은 얇게 제조해야 합니다. 그러나 균질하고 얇은 산화막을 제조하는 것은 매우 복잡하기 때문에 지금까지 습식 화학 공정으로만 만들어왔습니다. 그러나 최근 건식 공정의 발전으로 얇은 산화막을 제조할 수 있게 되었기 때문에 장기적으로는 건식공정을 선택할 수 있습니다. 또 다른 가공 방법으로는 에어로졸 침전 (Aerosol deposition)이나 압출 (Extrusion)(Extrusion) 방법도 사용할 수 있습니다.
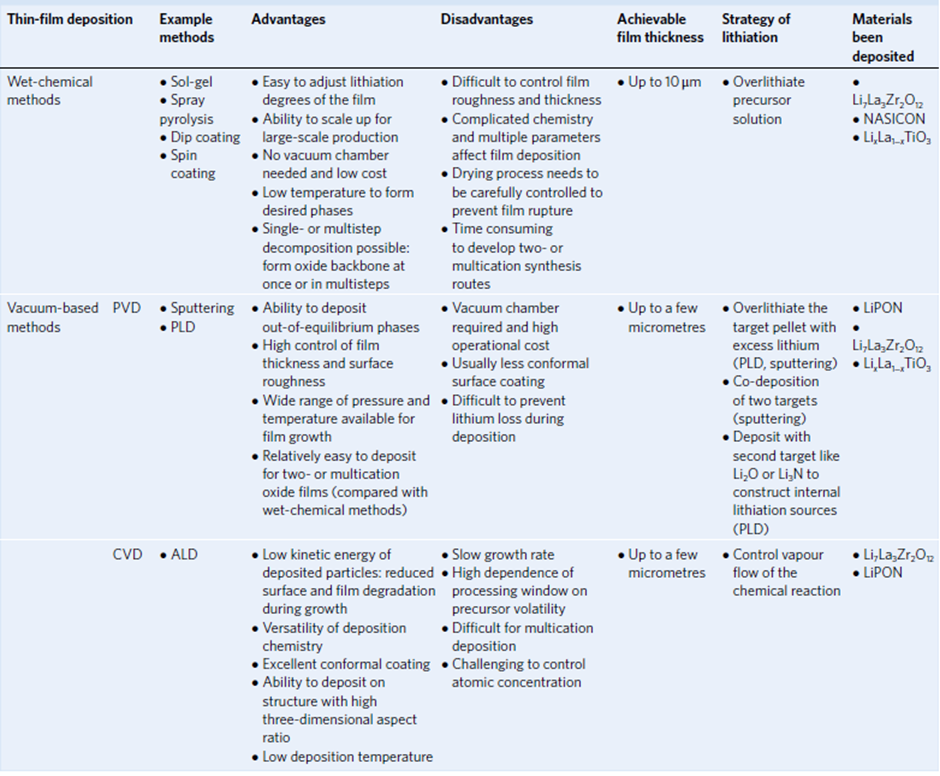
산화물 고체 전해질의 종류

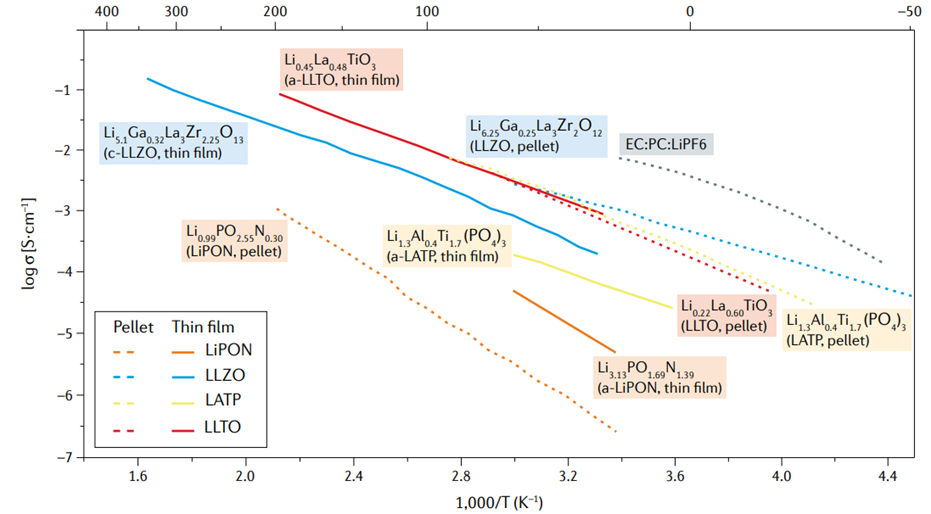
산화물 고체 전해질은 LiPON, NASICON, Garnet 및 Perovskite형 전해질로 분류될 수 있습니다. 이러한 전해질들은 이온 전도도와 소결 온도 및 처리 환경 등에서 차이가 있습니다.
1) LiPON (lithium phosphorus oxynitrides)
본격적으로 전고체 배터리용 고체 전해질이 개발되기 전에도 LiPON을 기반으로 한 박막 전고체 매크로 배터리가 개발되었고 1970년대에 발표되었습니다. 전고체전지의 가장 큰 문제점 중 하나는 이온 전도도의 한계이기 때문에 이온의 이동 거리를 짧게 하는 것이 이 문제를 해결하는 하나의 방법이었기 때문에 Oak Ridge National에서 개발된 최초의 유리상 (glassy phase)의 LiPON 고체 전해질 중 하나는 박막으로 제조되었습니다. 박막으로 제조된 LIPON고체 전해질은 2 x 10-3mS/cm의 이온 전도성을 달성했으며 스퍼터링 공정을 통해 제조되었습니다. 현재 시중에는 LiPON을 사용하는 마이크로 배터리 셀의 다양한 조합이 있으며, 가장 일반적으로 양극으로는 LiCoO2, 음극으로는 Li 금속을 사용합니다.
SEI가 잘 형성된 LIPON전해질은 전기 화학적으로 안정적이어서 수명이 길며 제조 과정에서 열처리가 필요하지 않고 기계적으로 안정하며 다양한 전극 재료와 함께 사용할 수 있다는 장점이 있습니다. 그러나 LiPON은 전도도가 낮기 때문에 고전류를 사용하는 배터리에 사용하기 위해서는 매우 얇게 코팅을 해야 합니다. 대용량 배터리에서는 얇게 코팅한 전해질을 사용하기 어렵기 때문에 주로 의료기기용 마이크로 배터리에 사용됩니다.
2) NASICON 타입
1990년대에는 전해질 두께를 두껍게 할 수 있는 전고체 전해질인 NASICON 타입이 개발되었습니다. 가장 처음 발표된 LATP는 Li1+x Ax Ti2-x(PO4)3인데 A에는 Al, Cr, Ga, Fe, In, La, Sc, Y등을 사용할 수 있었고 이온전도도는 약 1mS/cm였습니다. 이후 Li1+x Alx Ge2-x (PO4 )3의 구조를 갖는 LAGP가 발견되었으며 여기에 크롬을 첨가한 Li1+x+yAlxCryGe2 − x − y(PO4)3, (x + y = 0.5) 는 6.65 mS/cm의 이온 전도도를 달성했습니다.
NASICON이라는 이름은 원래 나트륨(Na) 전도성 산화물(Natrium conducting oxides)에서 유래되었지만 전고체 배터리에서는 Na가 리튬으로 대체되었고 이후로도 계속 NASICON이라는NASICON 명칭을 사용하고 있습니다.
NASICON유형의 고체전해질 중 LATP는LATP 대기에서의 안정성이 뛰어나 취급이 까다롭지 않고 소결 온도가 600~700°C로 산화물 재료 중 가장 낮습니다. (LIPON 박막 산화물 제외). 공정을 최적화하게 되면 소결온도를 400°C 미만으로 낮출 수 있다는 연구결과가 있습니다. NASICON 유형의 전해질은 산화물 중에서 이온 전도도가 가장 높고 높은 전위창 (5V)을 가지기 때문에 고전력 (High Power) 배터리의 Catholyte로 사용하기에 적합합니다.
반면에 LATP는 리튬 금속 음극에 대한 화학적으로 불안정한 단점이 있습니다. 이를 개선하기 위해 LATP바깥쪽에LAGP층을 만들어 LATP가 리튬메탈 음극과 직접적으로 접촉하지 않도록 하는 방법이 있습니다. 그러나 LAGP는 게르마늄이 포함되어 있기 때문에 가격이 비싸고 LAGP도 장기적으로 Li 금속에 노출되게 되면 안전성에 제한이 있습니다.

NASICON 산화물의 또 다른 단점은 Garnet이나 Perovskite형 산화물과 비교하여 열적 특성이 낮다는 것입니다. 아래 그림과 같이 산화물을 종류별로 ARC테스트를 진행해 보면 NASICON타입의LAGP 및 LATP의 경우 약 300°C에서 열폭주가 발생합니다. Perovskite형의 LLTO도 열폭주가 발생하지만 LATP와 LAGP보다는 약하게 발생하며 Garnet형의 LLZO의 경우에는 열폭주가 발생하지 않습니다.
3) Garnet 타입
Garnet 타입의 산화물은 가장 유망한 고체전해질 재료입니다.
Garnet 고체 전해질은 Li6ALa2Ta2O12 (A=Sr, Ba) 조성으로 처음 개발되었으며, 2005년에 4 x 10-2 mS/cm의 이온 전도성을 달성했습니다. 그 후, Li7La3Zr2O12(LLZO)가 개발되었는데 LLZO는 약 1mS/cm의 이온 전도도를 달성하였습니다.
Garnet형 고체 전해질의 장점은 리튬 대비 최대 6V의 넓은 전기화학 창을 가진다는 것입니다. 또 다른 장점은 리튬 금속 음극과도 화학적으로 안정하다는 것입니다. 일반적인 다른 산화물 재료들은 코팅이나 인공적인 SEI를 산화물 표면에 추가적으로 처리해야만 리튬금속과의 반응을 막을 수 있지만 LLZO는 추가적인 처리가 필요하지 않습니다.
Garnet형 산화물은 산화물 재료 중 열 안정성이 가장 높으며 열 폭주에도 안정적입니다. 첨가제를 사용하면 이온 전도도가 약 1mS/cm까지 가능하므로 분리막으로 사용하기에 적합합니다.
반면에 Garnet형 산화물의 단점은 자원이 풍부하지 않은 란타늄 (La)을 사용해야 하고 1000°C 이상의 높은 소결 온도로 가공해야 하므로 비용이 발생합니다. 또한 높은 소결온도는 Catholyte로 사용할 경우 양극 활물질과 어닐링 하는 온도를 높여야 하는 문제가 발생하게 됩니다. 어닐링 온도를 낮추는 것은 가능하지만 일반적으로 어닐링 온도가 낮을수록 이온 전도도에 단점이 있으므로 Catholyte로 사용하기에는 어려움이 있습니다.
4) Perovskite type
Perovskite형 산화물은 NASICON이나 Garnet형 산화물보다 빠른 1980년대에 발견되었고 대표적인 Perovskite형 산화물은 LLTO(Li3xLa2/3-xTiO3)로 연료전지와 화학반응기에서 사용되고 있습니다.
LLTO는 약 1mS/cm의 이온 전도도를 가지고 있고 Li 금속 존재 시 안정적이지 않으며 환원 과정에서 분해됩니다.
ARC테스트 결과를 통해 열 안정성을 확인해 보면 250도 정도에서 약한 열폭주가 있어 NASICON형 산화물보다 좋지만 Garnet형 산화물보다 좋지는 않습니다.
이처럼 Perovskite형 산화물은 다른 산화물들에 비해 뚜렷한 장점이 없기 때문에 고체전해질로 많이 연구가 되고 있지 않습니다.
출처: Solid-State Battery Roadmap 2035+ (Fraunhofer ISI report)
'배터리 > 전고체 배터리 (All Solid State Battery)' 카테고리의 다른 글
| 전고체 배터리 전망_폴리머 고체 전해질 (1) | 2023.11.17 |
|---|---|
| 전고체 배터리 전망_황화물 고체 전해질 (0) | 2023.11.15 |
| 전고체 배터리 전망_양극활물질 (0) | 2023.11.02 |
| 전고체 배터리 전망_음극활물질 (2) | 2023.11.01 |
| 전고체 배터리 전망_전고체 배터리의 구조 (0) | 2023.11.01 |
